식약처는 ‘2023년 의약품 임상시험 승인 현황’을 확인한 결과 ’23년 국내 임상시험 승인 건수는 783건이며, ’22년 대비 10.1% 증가했다고 5월 9일 밝혔다.
식품의약품안전처(처장 오유경)는 ‘2023년 의약품 임상시험 승인 현황’을 확인한 결과 ’23년 국내 임상시험 승인 건수는 783건이며, ’22년 대비 10.1% 증가했다고 5월 9일 밝혔다.
◆임상시험 건수 순위= ’23년 전 세계 임상시험 등록 건수를 살펴보면 우리나라가 ➀국가별 임상시험 순위 4위를 기록했고, ➁‘전 세계 도시별 임상시험’에서 서울이 1위, ➂‘단일국가 임상시험’은 우리나라가 3위로 ’22년과 같은 순위를 유지했다.
또한, 우리나라는 ➃‘다국가 임상시험’에서 ’22년 대비 한 단계 상승한 10위를 기록하고 아시아 국가 중에서는 여전히 가장 높은 순위를 기록했다.
◆국내 임상시험 현황= ’23년 국내 임상시험에서는 ➊제약사 주도 임상시험 비중이 증가하고, ➋국내 제약사가 개발한 임상시험의약품을 사용한 임상시험이 증가하였다.
➊전체 임상시험 중 ‘제약사 주도 임상시험’ 승인 건수는 660건으로, 전체 임상시험 승인 건수 중 84.3%를 차지하며 ’22년(83.7%) 대비 0.6%P 증가했다. ‘연구자 임상시험’은 비중이 조금 감소했지만 승인 건수는 증가했다.
➋국내 제약사가 개발한 의약품을 사용한 임상시험은 ’22년 대비 6.2% 증가한 반면, 해외 제약사가 개발한 의약품을 사용한 임상시험은 14.5% 증가했다.
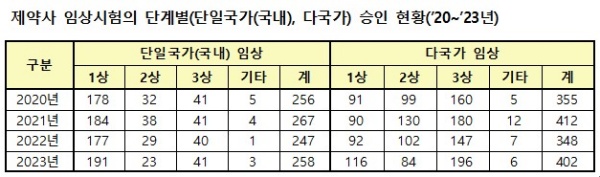 제약사 임상시험의 단계별(단일국가(국내), 다국가) 승인 현황(’20∼’23년)(자료 식약처 제공).
제약사 임상시험의 단계별(단일국가(국내), 다국가) 승인 현황(’20∼’23년)(자료 식약처 제공).우리나라에서만 수행하는 임상시험은 국내 업체의 복합제 개발 등을 위한 1상 임상시험 등 191건 승인되어 ’22년(177건) 대비 7.9% 증가했으며, 다국가 임상시험은 다국적 제약사의 신약 개발을 위한 3상 임상시험 등 196건 승인되어 ’22년(147건) 대비 33.3% 증가했다. 또한 감염병(항생제 등)에 대한 임상시험 승인 건수는 26건으로 ’22년(41건) 대비 36.6% 감소했다.
‘2023년 의뢰자별 임상시험 승인 현황’에 따르면, 한국아스트라제네카 23건, 한국로슈 20건, 보령(구 보령제약) 20건, 종근당 19건, 한국얀센 19건, 글락소스미스클라인(GSK) 13건, 대웅제약 12건, 한국애브비 12건, 한국노바티스 12건 등으로 나타났다.
식약처는 “감염병 대유행 이후 임상시험 승인 건수가 증가하는 추세로 앞으로도 임상시험을 통한 환자들의 신약 접근성을 제고하기 위해 제도를 정비할 예정이며, 국내 임상시험 정책이 국제 표준을 선도할 수 있도록 최선을 다해 노력하겠다”고 밝혔다.